Фолаты и психические заболевания
Шаблон
нутрицифтической формулы
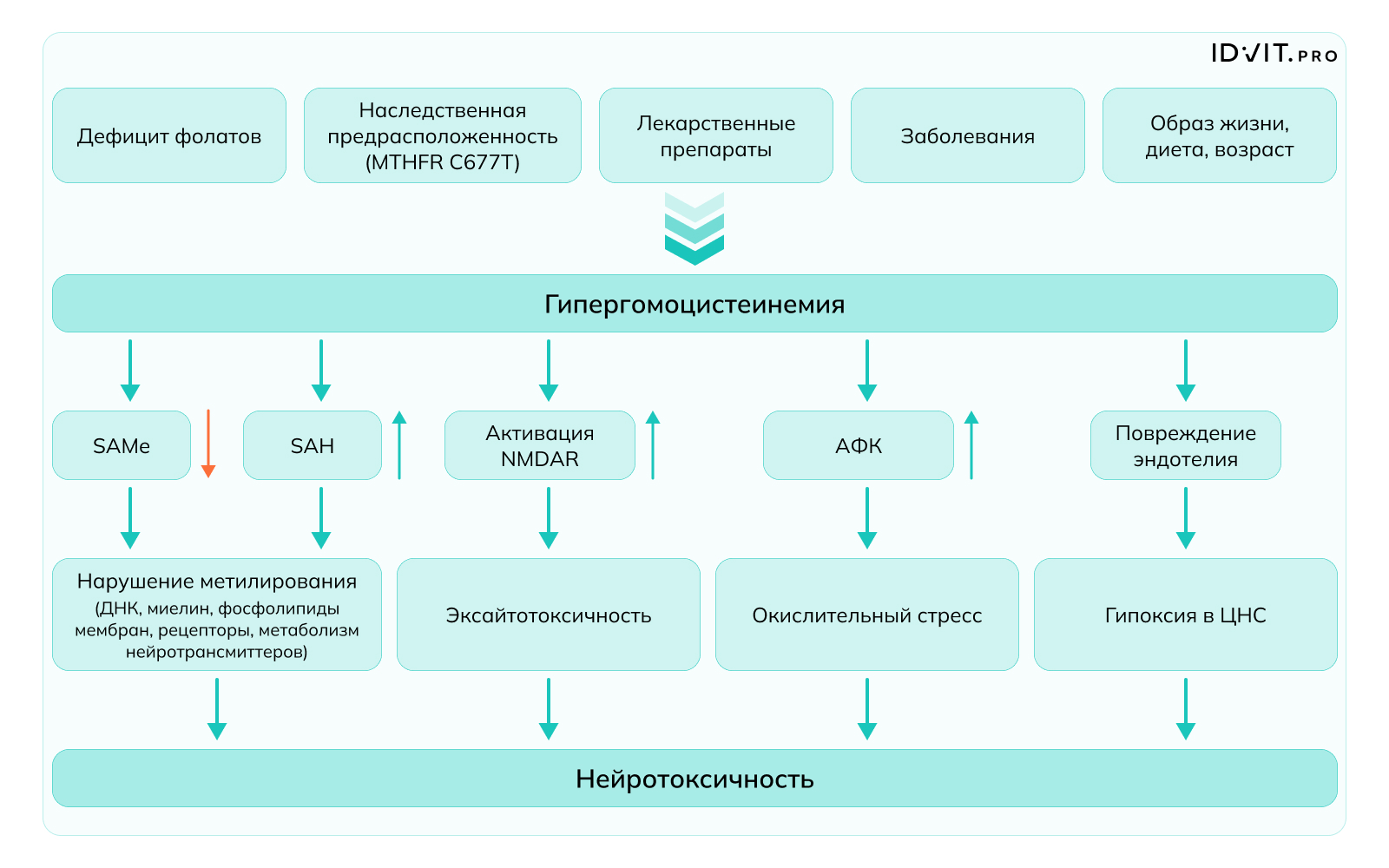
Многочисленные исследования показывают, что существует связь между дефицитом фолиевой кислоты и психическими заболеваниями, включая депрессию и биполярное расстройство, причем степень дефицита В9 коррелирует с тяжестью течения этих заболеваний. Фолат участвует в синтезе ВН4 (тетрагидробиоптерин), способствуя его регенерации из окисленной формы, и при недостатке фолата может снизиться продукция моноаминовых нейротрансмиттеров – серотонина, норадреналина и дофамина. Кроме того, доступность фолатов влияет на уровень гомоцистеина, повышенный уровень которого нарушает цикл метилирования – уровень SAH (S-аденозилгомоцистеина) повышается, а уровень SAM (S-аденозилметионина) понижается. Следствием такого дисбаланса становится активация рецепторов NMDA (N-метил-D-аспартата), которые играют ключевую роль в формировании возбуждения в нервной системе. Чрезмерная активация NMDA способствует нейрональной эксайтотоксичности и окислительному стрессу. В дополнение эндотелиальная дисфункция и повышенная продукция активных форм кислорода (ROS), связанная с гипергомоцистеинемией, могут оказывать пагубное воздействие на здоровье и целостность сосудов, нарушать кровоток и доставку питательных веществ в мозг, еще больше усугубляя повреждение нейронов и проявление психических заболеваний
Вариации в структуре гена метилтетрагидрофолатредуктазы (MTHFR) ассоциированы с риском развития некоторых психических заболеваний. Почти два десятилетия назад, в 2006, Lewis et al. выявили, что у людей с генотипом TT (C677T) риск развития депрессии выше примерно в 1,37 раза. Позднее было показано, что вариант гена MTHFR влияет на вероятность рецидива большого депрессивного расстройства [Lok et al. 2013]. Zhang et al. в 2022 году суммировали накопленные к тому моменту опубликованные данные и обнаружили, что полиморфизм MTHFR C677T связан с шизофренией и большой депрессией в общей популяции. MTHFR C677T был связан с повышенным риском биполярного расстройства в рецессивной модели (TT против CT + CC). Анализ этнических подгрупп показывает, что шизофрения и большое депрессивное расстройство значительно коррелируют с MTHFR C677T и A1298C в азиатской популяции, но не у европеоидной. Кроме того, шизофрения значимо коррелирует с MTHFR C677T в африканской популяции.
Использование препаратов фолиевой кислоты доказанно улучшает состояние пациентов с психическими заболеваниями:
| Воздействие | Эффект |
|---|---|
| Депрессия (в т.ч. большое депрессивное расстройство и устойчивая к СИОЗС депрессия) | |
| 10–40 mg циталопрама + 0.5 mg витамина В12 + 2 mg фолиевой кислоты + 25 mg витамина В6 ежедневно в течение 12-52 недель. Группа плацебо получала аналогичное количество циталопрама | Ремиссия симптомов: 12 нед. — 78.1% (плацебо) vs 79.4%; 26 нед. — 76.5% vs 85.3%; 52 нед. — 75.8% vs 85.5% [Ford et al., 2010; Almeida et al., 2014] |
| 15 mg метилфолата + СИОЗС (30 дней) Плацебо: СИОЗС |
Улучшение по шкале депрессии Гамильтона и самооценке [Papakostas et al., 2012] |
| 20 mg флуоксетина + 1.5 mg или 5 mg фолиевой кислоты (6 нед.) Нет группы плацебо |
5 mg > 1.5 mg по шкале Гамильтона и Бека [Venkatasubramanian et al., 2013] |
| 20 mg циталопрама + 2.5 mg фолиевой кислоты (8 нед.) Плацебо: циталопрам |
Ответ на лечение: 73.3% (интерв.) vs 40.0% [Sepehrmanesh et al., 2016] |
| 20 mg флуоксетина + 10 mg фолиевой кислоты (6 нед.) Плацебо: флуоксетин |
Более выраженное снижение шкалы Гамильтона и уровня гомоцистеина [Resler et al., 2008] |
| 20 mg флуоксетина + 0.5 mg фолиевой кислоты (10 нед.) Плацебо: флуоксетин |
Женщины: улучшение 6.8 vs 11.7; 93.9% vs 61.1% реакция на лечение [Coppen, Bailey, 2000] |
| 15 mg L-метилфолата (12 мес.) | 26/68 — полное выздоровление; 14/53 — ответ при устойчивости к терапии [Zajecka et al., 2016] |
| Шизофрения | |
| 2 mg фолата + 400 µg витамина B12 (16 нед.) | Улучшение негативных симптомов при учете генотипа 484C>T / 484TT [Roffman et al., 2013] |
| Антипсихотики + 15 mg L-метилфолата (24 нед.) Плацебо: только препараты |
Улучшение по шкале PANSS; учитывался генотип [Roffman et al., 2018] |
| Антипсихотики + 1 mg фолиевой кислоты (12 нед.) Плацебо: только препараты |
Эффект при учете генотипа; у носителей аллеля T наблюдалось улучшение [Hill et al., 2011] |
| 2 mg фолиевой кислоты + 25 mg пиридоксина + 400 µg витамина B12 (3–6 мес.) | Снижение гомоцистеина и улучшение симптомов [Levine et al., 2006] |
| РАС (расстройства аутистического спектра) | |
| 2 mg/kg лейковорина (12 нед.) | Улучшение у FRAA+ пациентов по ряду шкал [Frye et al., 2018] |
| 5 mg лейковорина 2x/день (12 нед.) | Улучшение ADOS и коммуникации [Renard et al., 2020] |
| 2 mg/kg (до 50 mg) лейковорина (12 нед.) | Улучшение по подшкале речи ABC-C [Batebi et al., 2021] |
| 75 mkg/kg метилкобаламина (инъекции) + 400 μg лейковорина 2x/день (3 мес.) | Улучшение по всем подшкалам шкалы Вайнленда [Frye et al., 2013] |
| 75 mkg/kg метилкобаламина 2x/нед. + 400 μg лейковорина 2x/день (3 мес.) | Улучшения в метаболизме и антиоксидантной системе [Frye et al., 2013] |
| 400 μg фолиевой кислоты 2x/день (3 мес.) | Улучшение речевых и когнитивных навыков, гомоцистеина и глутатиона [Sun et al., 2016] |
| Биполярное аффективное расстройство | |
| 1300 mg вальпроата натрия + 3 mg фолиевой кислоты (3 нед.) Плацебо: вальпроат |
Улучшение в острой фазе мании [Behzadi et al., 2009] |
| Антипсихотики + 15 mg L-метилфолата (6 нед.) | Снижение MADRS: 23.4 → 13.9; улучшение ≥50% у 6/10 пациентов [Nierenberg et al., 2016] |
Следует, однако, учитывать, что высокие дозы витамина В9, в том числе в форме метилтетрагидрофолата, обладают разнообразными побочными эффектами, включая риск развития эндокринных нарушений, эпизоды психоза, ослабление иммунитета (например, снижение цитотоксичности NK-клеток). Считается, что проявление побочных эффектов происходит вследствие накопления «непереработанной» фолиевой кислоты, развития т.н. псевдо-MTHFR-дефицита, дисбаланса в обмене витамина В12 и эпигенетических изменений [Fardous et al., 2023; Firth et al., 2019]. Наиболее оправданной стратегией в случае необходимости приема витамина В9 является выявление генетического варианта ферментов фолатного цикла (MTHFR – метилентетрагидрофолатредуктаза, MTR – B12-зависимая метионинсинтаза и MTRR – метионинсинтаза-редуктаза) и регулярное лабораторное определение уровня фолиевой кислоты в организме. Только при должном контроле применение высоких доз фолатов может считаться безопасным.
«Точки приложения» фолатов в коррекции метаболических отклонений при психических заболеваниях
Психические заболевания – чаще всего сложные расстройства, при которых изменения наблюдаются во многих областях мозга и затрагивают разнообразные процессы в нейронах и нейронных сетях. Антидепрессанты, антипсихотические и другие типы препаратов используются для повышения синаптической пластичности, что положительно сказывается на симптомах заболеваний. Наличие устойчивых к лечению форм психических заболеваний, широкий спектр побочных действий и продолжающиеся научные исследования указывают на необходимость поиска новых подходов в психиатрии, в том числе с целью коррекции метаболических отклонений.
Модуляция рецептора NMDA
Баланс между глутаматом (GLU) и гамма-аминомасляной кислотой (GABA, ГАМК) является одной из основных мишеней при лечении психических заболеваний и депрессии, т.к. нарушения в GLU/GABA отмечаются при большинстве нервно-психических заболеваний. Кроме того, чрезмерная активация NMDA, которая наблюдается при ишемии мозга, приводит к эксайтотоксичности, гибели нейронов и потере нейропластичности [Liang et al., 2023], и аналогичные негативные явления часто сопровождают депрессию и возрастные когнитивные нарушения. Рецептор NMDA играет ключевую роль в синаптической пластичности и участвует в различных нейронных процессах, включая обучение, память и регуляцию настроения. Блокируя рецептор NMDA, можно изменять сигналы, передаваемые через GLU и влиять на равновесие в системе возбуждение / торможение. Действие фолиевой кислоты в данном случае реализуется через нормализацию уровня гомоцистеина, который действует как агонист NMDA. Эффект приема фолиевой кислоты можно сравнить с эффектом кетамина, который назначается как антиглуматэргический агент (антагонист NMDA) [Canavero, Bonicalzi, 2018; Bhatia, Singh, 2015]. Вероятно, совместный прием кетамина и поддержка фолиевой кислотой будет еще более эффективно справляться с проявлением депрессии [Liwinski, Lang, 2023].
Противовоспалительное действие фолиевой кислоты
Для пациентов с психическими заболеваниями часто отмечается хроническое воспаление, для которого характерно повышение уровней С-реактивного белка, ИЛ-6 и ФНО-альфа и других медиаторов воспаления [Valkanova et al., 2013; Dregan et al., 2019; Bauer, Teixeira, 2019; Ferat-Osorio et al., 2024]. Провоспалительные цитокины могут работать как вторичные мессенджеры и активировать микролию, влиять на глутаматергический путь и систему триптофана и кинуренина [Brown et al., 2021; Li et al., 2022]. Эти пути играют важную роль в регуляции нейротрансмиттеров и нейронной функции, и их дисбаланс может способствовать развитию и прогрессированию депрессии и психических заболеваний. Косвенно значимость воспаления в генезе и развитии симптомов психических расстройств доказывается эффективностью противовоспалительной терапии [Bai et al., 2020]. Обеспечение организма фолатами является профилактикой эндотелиальной дисфункции при воспалительных заболеваниях, средством модуляции иммунных процессов за счет влияния на метилирование ДНК, а также фактором, способствующим снижению уровня гомоцистеина [Liwinski et al., 2023].
Ось «кишечник-мозг»
Результаты многочисленных исследований указывают на связь между микробиомом и психическими заболеваниями, однако эта связь описывается как корреляционная, а причинно-следственные взаимоотношения между микробиотой и организмом человека пока только изучаются [Góralczyk-Bińkowska et al., 2022]. Тем не менее, известно, что микроорганизмы обладают способностью переваривать такие компоненты пищи, которые человеческий организм усвоить самостоятельно был бы не способен (пищевые волокна), синтезируют витамины (К, биотин, пантотеновая кислота, некоторые витамины группы В). Стимулирование выработки фолатов микроорганизмами микробиоты обладает потенциалом в лечении психических заболеваний, т.к. часть фолатов производится бактериями в толстом кишечнике и влияет на общий статус витамина в организме человека [Schaub et al., 2022]. Кроме того, целостность кишечной стенки и баланс в микробном сообществе кишечника снижает риск воспаления, которое является фактором развития нервно-психических заболеваний [Ortega et al., 2023].
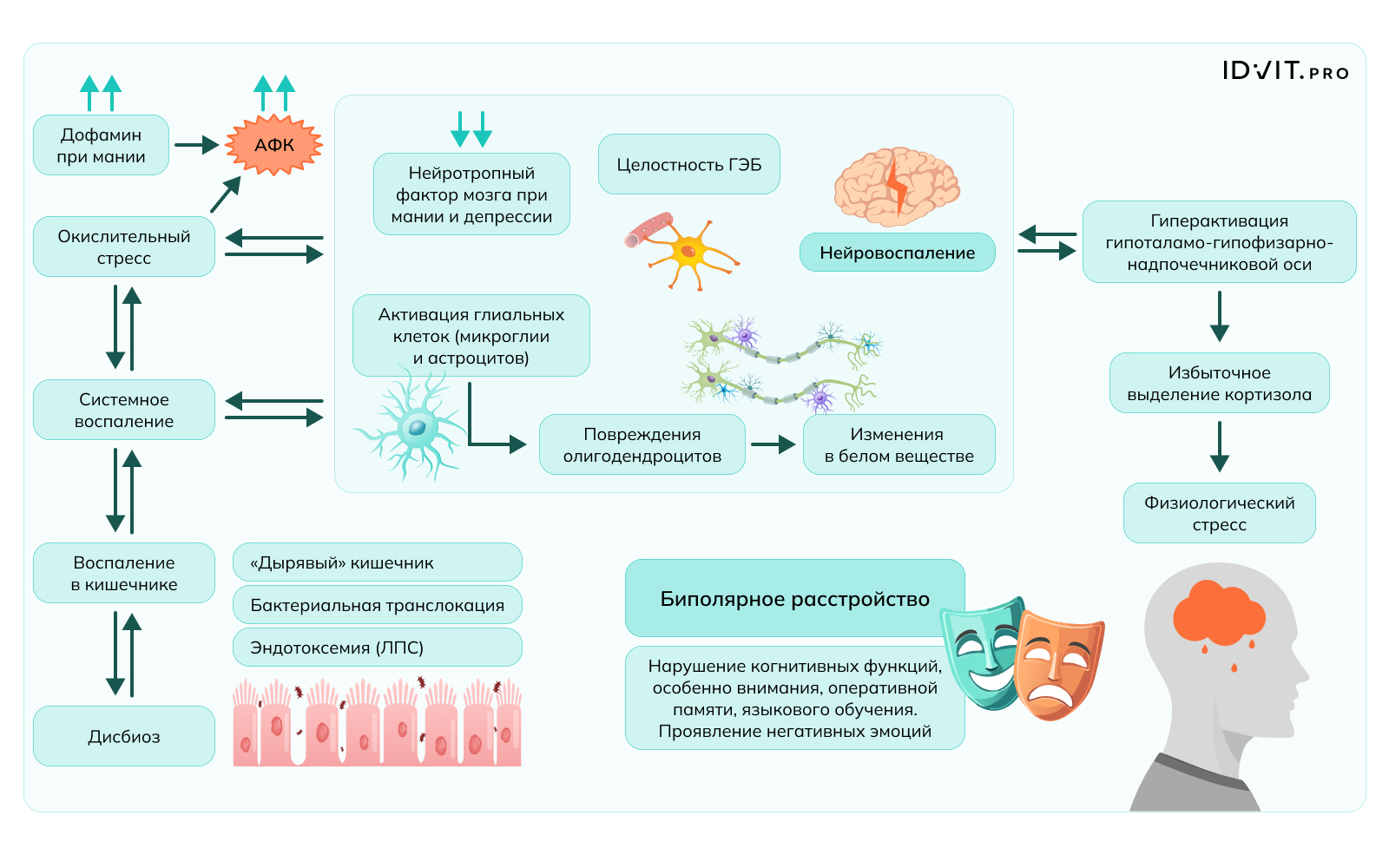
Повышенная проницаемость кишечной стенки способствует бактериальной транслокации и последующей эндотоксемии, что является основным фактором воспаления, локального (кишечного) и системного. Хроническое воспаление вызывает нарушение целостности ГЭБ и активирует глию. Следствием становится повреждение олигодендроцитов, что вызывает дисбаланс в миелинизации и, следовательно, изменения в белом веществе. Этот каскад событий приводит к нейровоспалению, которое способствует клиническим проявлениям биполярного расстройства [Ortega et al., 2022].
Многочисленные исследования показывают, что существует связь между дефицитом фолиевой кислоты и психическими заболеваниями, включая депрессию и биполярное расстройство, причем степень дефицита В9 коррелирует с тяжестью течения этих заболеваний. Фолат участвует в синтезе ВН4 (тетрагидробиоптерин), способствуя его регенерации из окисленной формы, и при недостатке фолата может снизиться продукция моноаминовых нейротрансмиттеров – серотонина, норадреналина и дофамина. Кроме того, доступность фолатов влияет на уровень гомоцистеина, повышенный уровень которого нарушает цикл метилирования – уровень SAH (S-аденозилгомоцистеина) повышается, а уровень SAM (S-аденозилметионина) понижается. Следствием такого дисбаланса становится активация рецепторов NMDA (N-метил-D-аспартата), которые играют ключевую роль в формировании возбуждения в нервной системе. Чрезмерная активация NMDA способствует нейрональной эксайтотоксичности и окислительному стрессу. В дополнение эндотелиальная дисфункция и повышенная продукция активных форм кислорода (ROS), связанная с гипергомоцистеинемией, могут оказывать пагубное воздействие на здоровье и целостность сосудов, нарушать кровоток и доставку питательных веществ в мозг, еще больше усугубляя повреждение нейронов и проявление психических заболеваний.
Список литературы
Пример базовой сигнатуры
СкачатьРазвитие депрессии, индуцированной воспалением, связанным с дефицитом фолиевой кислоты
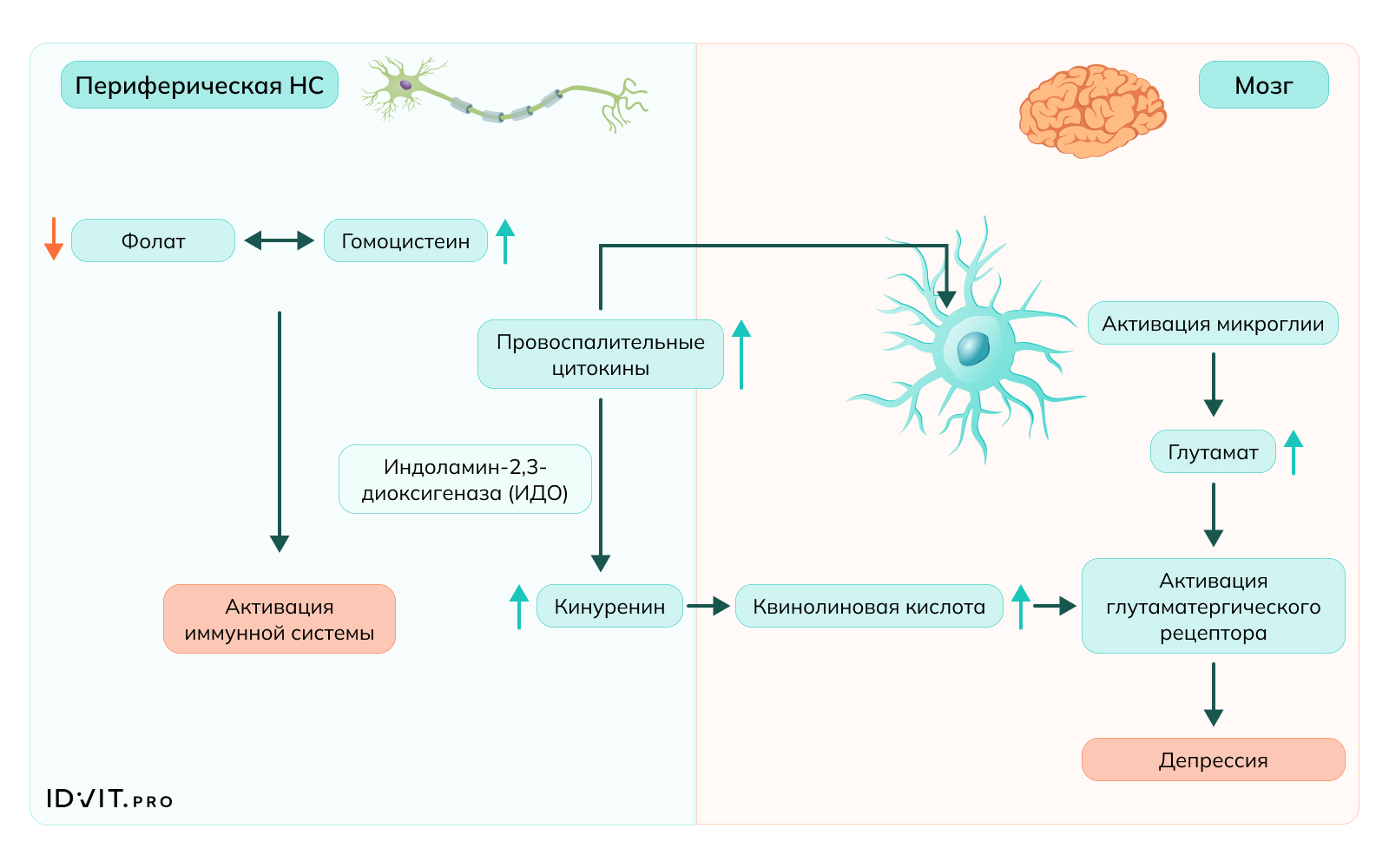
Воспалительные стимулы запускают выработку провоспалительных цитокинов, которые активируют различные ферментативные процессы. Одним из таких процессов является превращение триптофана в кинуренин, катализируемое индоламин-2,3-диоксигеназой (IDO). Передача сигналов цитокинов в мозг стимулирует активацию микроглии, что приводит к выработке воспалительных медиаторов. Одновременно кинуренин транспортируется в мозг, где он далее метаболизируется в нейротоксичные соединения, включая хинолиновую кислоту. Активированная микроглия также выделяет глутамат, ключевой возбуждающий нейротрансмиттер. Как глутамат, так и хинолиновая кислота способствуют усилению глутаматергической нейротрансмиссии, что в конечном итоге приводит к развитию депрессивных симптомов [Liwinski, Lang, 2023].
 Вход
Вход